Většinu lidí alespoň jednou v životě bodly vosy, včely nebo jiní drobní obyvatelé fauny. Málokdo však ví, že obyvatelé a hosté jižních oblastí Ruska jsou často kousnuti členovcem s tak exotickým jménem – stonožka.
Kdo jsou stonožky a proč koušou lidi
Scolopendra je rod velkých stonožek, které žijí téměř všude. Obecně se uznává, že největší a nejnebezpečnější zástupci rodu se nacházejí výhradně v horkých tropických zemích. Na území jižních oblastí Ruska však žije také jeden z četných a ne nejnebezpečnějších druhů stonožky, kroužková nebo krymská stonožka.
Tato zvířata nikdy nevykazují agresi vůči lidem bez dobrého důvodu.
Jeho stanovištěm jsou různé soutěsky, houštiny, staré pařezy a kmeny stromů. Členovec preferuje tmu a vysokou vlhkost a ve dne se jen zřídka dostane ze svého úkrytu.

Scolopendra jsou aktivní pouze v noci. S nastupující tmou se vydávají na lov a již ráno začínají hledat vhodný úkryt. Z tohoto důvodu stonožky často lezou do turistických stanů nebo se schovávají uvnitř věcí, které zůstaly na ulici – boty, oblečení nebo batohy.
Výsledkem je, že zvíře vyrušené probuzenými lidmi projevuje agresivitu a může člověka nejen kousnout, ale také uvolnit toxický hlen. Za zmínku také stojí, že nejen turisté, ale i běžní obyvatelé teplých oblastí by si měli dávat pozor na kousnutí stonožky, protože stonožka často leze do domů při hledání jídla.
Jaké je nebezpečí kousnutí scolopendra pro člověka
Jak víte, jed scolopendra je poměrně toxický a jeho kousnutí může být smrtelné pro malá zvířata, kterými se živí. Pro člověka kousnutí scolopendra nejčastěji nepředstavuje vážné nebezpečí, ale může přinést spoustu problémů.
Předpokládá se, že nejnebezpečnější koncentrace jedu ve žlázách stonožek je pozorována na jaře, kdy se stonožky připravují na reprodukci. Ale jejich jed není o nic méně nebezpečný i jindy. Pro osobu kousnutou scolopendrou jsou charakteristické následující příznaky:
- silná bolest v místě kousnutí;
- otok
- obecná malátnost;
- zvýšení tělesné teploty na 38-39 stupňů;
- zimnice;
- bolesti v těle;
- nevolnost;
- zvracení;
- rozrušený gastrointestinální trakt;
- závratě.
U zdravého dospělého obvykle příznaky odezní během 1-2 dnů. Kousnutí scolopendrou je nejnebezpečnější pro malé děti, alergiky a lidi s oslabeným imunitním systémem. Pro ně mohou být následky setkání s nebezpečnou stonožkou mnohem závažnější.
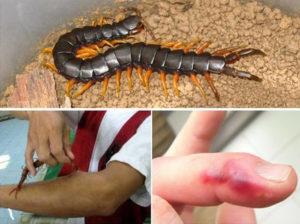
Stojí za zmínku, že nejen přímé kousnutí může způsobit poškození člověka, ale také speciální hlen, který scolopendra vylučuje. Kontakt kůže s touto látkou může způsobit:
- silné zarudnutí;
- svědění;
- nepříjemné pálení.
Co dělat s kousnutím scolopendra
Neexistují žádná speciální doporučení pro první pomoc při kousnutí stonožkou.
- Nejprve je třeba čerstvé sousto dezinfikovat ošetřením kapalinou obsahující alkohol a obvázat běžným gázovým obvazem.
- Poté by pokousaná osoba měla okamžitě vyhledat lékaře a to by mělo být provedeno co nejdříve. Navíc to platí nejen pro ohrožené osoby, ale také pro absolutně zdravé lidi, protože individuální reakce na toxickou látku může být nepředvídatelná.
Jak se chránit před kousnutím scolopendra
Nejdůležitějším pravidlem při setkání se stonožkou je nesnažit se ji chytit holýma rukama, a když na sobě stonožku objevíte, už vůbec byste neměli dělat prudké pohyby.
Panika a aktivní mávání rukama zvíře jen vyděsí a vyděšená stonožka začne být agresivní a pravděpodobně se pokusí pachatele kousnout a zanechat na něm jedovatý hlen.

Abyste se ochránili před kousnutím stonožky během venkovní rekreace, stačí dodržovat následující tipy:
- boty a oblečení by měly být před oblékáním velmi pečlivě zkontrolovány;
- před spaním je nutné pečlivě prohlédnout stan a spacák na přítomnost nezvaných hostů;
- nenocujte venku bez stanu ani jej nenechávejte v noci otevřený, protože to může být velmi nebezpečné;
- zvláštní opatrnosti je třeba dbát ráno, při sbírání věcí a stanu.
Závěr
Scolopendra by neměla být považována za nepřítele člověka. Toto zvíře přináší lidem hmatatelné výhody tím, že kontroluje populaci mnoha škodlivého hmyzu. Aby setkání se stonožkou proběhlo bez následků, stačí dodržovat výše uvedená doporučení a nesnažit se jí ublížit.
Kousnutí červené stonožky čínské narušuje činnost kardiovaskulárního, nervového a dýchacího systému, hlavní složkou jeho jedu je toxin SsTx, ale lék retigabin, který se používá při epilepsii, jeho toxicitu neutralizuje. Zjistili to vědci z Číny a USA v práci publikované v časopise Sborník z Národní akademie věd.

Ve světě zvířat existují predátoři, kteří jsou schopni zabít kořist, jejíž velikost těla přesahuje velikost predátora. Dělají to pomocí jedu a mohou jednat kolektivně. Takto loví někteří mravenci, pavouci, štíři a stonožky – středně velké členovce, jejichž délka dosahuje 35 centimetrů, ale jejich jed je pro člověka nebezpečný a může vést k vazospasmu, akutní hypertenzi, ischemii myokardu a dokonce i smrti. Lei Luo z Institutu zoologie v Kunmingu se spolu s kolegy z univerzit v Číně a USA rozhodla prostudovat vlastnosti stonožkového jedu, jeho vliv na oběť a najít protijed.
Při své práci používali jed čínské červené scolopendry (Scolopendra subspinipes mutilans) vážící asi tři gramy a myši, jejichž průměrná hmotnost byla 45 gramů. Když byla myš umístěna blízko stonožky, okamžitě na ni zaútočila a do 30 sekund byla myš neutralizována. Pololetální dávka jedu byla 120 miligramů na kilogram a 93 miligramů na kilogram při intramuskulární a intraperitoneální aplikaci; To je dávka, při které polovina subjektů zemře.
Vzhledem k tomu, že příznaky otravy stonožkou připomínají případy kousnutí štírem a pavoukem, vědci navrhli, že jed stonožky se zaměřuje také na iontové kanály – to jsou transportní proteiny, které pomáhají iontům pohybovat se buněčnou membránou. Vědci vystopovali složku, která vede ke smrti oběti, ukázalo se, že jde o malý peptidový toxin SsTx. Jeho účinek byl testován na několika iontových kanálech a bylo zjištěno, že má silný inhibiční účinek na draslíkové kanály KCNQ, zejména KCNQ4, přičemž vysoké koncentrace draslíku zvyšují hodnotu semiletální dávky.
Vědci testovali účinky stonožkového jedu na kardiovaskulární systém a zjistili, že kontrakce koronárních tepen se zvýšila o 80 procent po podání 5 mg/ml jedu a o 105 procent po podání 10 mg/ml jedu a podání 10 mg/ml jedu bez toxinu SsTx se pouze kontrakce tepny zvýšila o 7,5 procenta.
Vzhledem k tomu, že toxin působí na draslíkové kanály a lék retigabin je otevírá, vědci testovali jeho účinek jako protijed.
Byl potvrzen účinek toxinu a antidota na kardiovaskulární systém in vivo: Injekce jedu vedly k akutní hypertenzi u myší a injekce 0,5 mg/kg toxinu způsobila vazokonstrikci a významné zvýšení krevního tlaku. Pololetální dávka toxinu byla 0,85 mg/kg. 1 mg/kg retigabinu zvrátilo hypertenzi vyvolanou 0,1 mg/kg toxinu a normalizovalo krevní tlak.
Vědci také testovali účinek jedu na mozek, kvůli kterému vstříkli toxin do hipokampu myší, což vedlo k okamžitým záchvatům a smrti během 10-20 minut. Jed také ovlivnil fungování dýchacího systému: po intraperitoneální injekci toxinu 2 mg/kg se dechová frekvence snížila o 75 procent a amplituda dýchání se zvýšila o 150 procent. Vědci také potvrdili, že lokální podávání toxinu vede u myší k nekróze tkáně.
Autor tak mohl studovat účinek stonožkového jedu a potvrdit neutralizační účinek retigabinu jak při zavádění surového jedu, tak při zavádění toxinu SsTx do těla oběti. Vědci poznamenávají, že toxin neprochází bariérou mezi oběhovým a centrálním nervovým systémem, takže riziko neurotoxických příznaků u lidí není vysoké.
Jedovatá zvířata jsou někdy pro některé organismy jedovatá, pro jiné však neškodná. Mluvili jsme tedy o jedovatých čolocích, jejichž jed je proti některým druhům hadů bezmocný, a v jedu vos jsme našli toxin, který dokáže ničit rakovinné buňky. O nejjedovatějších zvířatech planety jsme hovořili v našem materiálu a o nejjedovatějších medúzách se můžete dozvědět na našem blogu.
Anna Zinina
Našli jste překlep? Vyberte fragment a stiskněte Ctrl + Enter.

O prasatech a lidech
Jak proměnit prasátko v bezpečného dárce orgánů
První a jediný člověk, který dostal geneticky modifikované prasečí srdce, s ním žil pouhých 60 dní. Ani po roce a půl lékaři stále nezjistili, proč zemřel, ale mají podezření, že imunitní systém pacienta se s transplantací stále nevyrovnal. Možná by se odmítnutí dalo předejít, kdyby byl pacientovi transplantován lidský orgán vyrostlý od nuly, například v těle stejného prasete. Nyní čínští vědci získali první prasečí embryo s rudimentem lidské ledviny a bylo možné vyhodnotit, co je vlastně jednodušší: přestrojit prasečí ledvinu za lidskou nebo vypěstovat ve praseti skutečnou lidskou ledvinu. Vepřové maso v člověku Cizí orgán v těle člověka se nikdy nestane jeho vlastním. A to i v případě, že transplantace byla úspěšná a dárce je blízký příbuzný. Téměř vždy po takové operaci musí člověk po celý život užívat léky, které potlačují činnost imunitního systému. Co můžeme říci o případech, kdy je dárcem zvíře jiného druhu. Ve druhé polovině 20. století lékaři s tímto druhem transplantací hodně experimentovali. Jenže se ukázalo, že na xenotransplantace nepomáhají ani imunosupresiva. Prasečí srdce a opičí játra zřídka vydržely v lidském těle déle než několik dní nebo měsíců. Lékaři opustili tyto pokusy a obrátili se o pomoc na genetiky. Navrhli chovat „humanizovaná“ prasata – tedy zvířata, jejichž tkáně bude lidský imunitní systém souhlasit, že je uzná za vlastní. Nejjednodušší věc, kterou pro to lze udělat, je odstranit z povrchu buněk molekuly, které v lidském těle v zásadě neexistují. V případě prasečích buněk se jedná o disacharidový fragment dvou galaktóz (galaktóza-alfa-1,3-galaktóza). Abyste se ho zbavili, musíte z prasečího genomu vyříznout gen GGTA1: kóduje enzym, který pomáhá připojit tento ocas k buněčné membráně. Knokaut tohoto genu stačí k tomu, aby se zabránilo tomu, že náplast prasečí kůže nebo dokonce celá prasečí ledvina způsobí okamžité odmítnutí po transplantaci. Ale pokud orgán musí zůstat v lidském těle po dlouhou dobu, pak během týdnů a měsíců bude imunitní systém schopen dosáhnout hůře dostupných neznámých molekul. To znamená, že musíte jednat mazaněji. Například můžete nainstalovat malý kousek brzlíku pod kapsli vepřové ledviny. To je orgán, který trénuje imunitní buňky, aby nereagovaly na molekuly vlastního těla. V souladu s tím by brzlík dárce mohl trénovat lymfocyty hostitele, aby byly trpělivé s transplantovanými buňkami. Pod takovou ochranou může vepřová ledvina žít v člověku nejméně měsíc. Nebo můžete jít ještě dál a být v bezpečí před všemi možnými komplikacemi najednou. To udělali genetici ze společnosti Revvicor. Provedli až deset změn v genomu prasete, jehož srdce bylo později transplantováno lidem: vymazali tři geny zodpovědné za výskyt cizích molekul na povrchu; vymazali gen receptoru růstového hormonu (aby srdce nereagovaly na hostitelský hormon a nerostly), přidali šest lidských genů (dva inhibují zánět, dva brání vrozeným imunitním proteinům ve vazbě na buňky, dva blokují srážení krve). Pacient ale stejně zemřel. Se svým novým srdcem žil dva měsíce – a pak najednou začalo selhávat. Lékaři stále přesně nevědí, co se stalo. Možná to byl virus, který přenášelo zvíře. Nebo třeba v protilátkách, které lékaři pacientovi předepsali, když zaznamenali známky infekce (protože po imunosupresi mu nezůstaly téměř žádné protilátky). Nebo – u prasečích protilátek, které se vytvořily v srdci dárce a nakonec způsobily imunitní odpověď. Tak či onak imunitní systém na něco zareagoval. K odmítnutí přesto došlo. Člověk ve vepře Zda se jednoho dne podaří přinutit prasečí srdce, aby se v člověku spolehlivě zakořenilo, nelze nyní říci. Doposud proběhla pouze jedna taková operace. A zatím je pouze jeden příjemce vepřové ledviny. Proto je příliš brzy posuzovat vyhlídky takových operací a jejich možné důsledky. Můžeme však s jistotou říci, že lidské orgány by se měly zakořenit lépe než prasečí a měly by s sebou nést méně rizik. Pokud se naučíte, jak je pěstovat. Sbírat životně důležité orgány in vitro zatím není možné, ale můžete je zkusit vypěstovat uvnitř živého organismu – například prasete. K tomu potřebuje vypnout gen zodpovědný za vývoj jejího vlastního orgánu a zasadit do svého embrya lidské buňky (více jsme o této metodě hovořili v materiálu „Pig Heart“). Pokud prase přežije a požadovaný orgán vyroste, můžeme s jistotou říci, že je to člověk. Pravda, k tomu budeme muset vyřešit ještě jeden problém – prasečí buňky nepřevlékat za lidské, ale naopak postarat se o to, aby se lidské buňky staly v prasečím embryu svými a nezabíjely je sousedé. Embrya chimér se obvykle odebírají, když jsou v nejranějších fázích vývoje. Prasečí embryo v tuto chvíli vypadá jako shluk buněk, které se ještě nezačaly distribuovat mezi orgány a tkáně. Můžete do ní napíchnout lidské embryonální kmenové buňky – jsou přibližně ve stejném stádiu – a doufat, že se promísí s davem a budou se podílet na stavbě orgánů stejně jako prasečí buňky. Protože v tak raném embryu není žádná tkáň, není tam žádná krev, což znamená, že imunitní odmítnutí je nemožné. Lidským buňkám však brání v klidné integraci jiný mechanismus – buněčná konkurence. Zdá se, že buňky uvnitř embrya vysílají signál svým sousedům, aby zahájili apoptózu. A pokud sousedé z nějakého důvodu neprodukují dostatek proteinů, které blokují apoptózu – například proto, že mají nějaké poškození nebo nemají dostatek energie – pak zemřou. Proto transplantované buňky v chimérických embryích špatně zakořeňují, zvláště pokud nemluvíme o blízce příbuzných živočišných druzích. Rekordní obsah lidských buněk, kterého bylo dosaženo u chimérického embrya u opice, je 7 procent, u myši – 4 procenta. V chimérách s prasaty donedávna lidské buňky přežívaly ještě hůře a tvořily jen zlomek procenta. Aby pomohli buňkám uvnitř chiméry přežít, vědci se snaží geneticky deaktivovat jejich program apoptózy. Američtí vědci tak v roce 2021 vytvořili buněčnou kulturu bez genu TP53, který kóduje hlavní protein v programu apoptózy. Když byly takové buňky implantovány do prasečího embrya, přežily a dokonce z nich začaly růst skutečné svaly – protože prasata byla odebrána s vadou ve vývoji svalů. Nyní se další skupina vědců, čínští biologové pod vedením Liangxue Lai, pustila do pěstování lidské ledviny uvnitř prasete – protože ledviny jsou k transplantaci potřeba mnohem více než svaly. Za tímto účelem vědci vložili konstrukt několika fragmentů DNA do genomu lidských buněk. Začalo to signální sekvencí, která reagovala na přítomnost specifického léku (doxycyklinu), což znamená, že geny po ní mohly být spuštěny příkazem. Další byly kopie dvou genů, z nichž jeden (BLC2) zastavuje apoptózu a druhý (MYCN) se podílí na dělení. Tento genetický design neměl zastavit program buněčné smrti, ale naopak podpořit program přežití. Kromě toho byly buňky značeny fluorescenčním proteinem, aby byly snadno vidět uvnitř chiméry. Poté, co byly tyto buňky „naprogramovány“ k přežití pomocí doxycyklinu, byly implantovány do prasečích embryí. A podle výpočtů autorů článku zabírali přibližně desetinu plochy embrya. Nemusí to nutně znamenat, že tvořily deset procent všech buněk, ale rozhodně v nich tvořily znatelný (pod fluorescenčním mikroskopem) zlomek. Aby ledvina vyrostla z lidských buněk, bylo potřeba upravit i hostitelské prase. Pomocí genových editorů vědci vytvořili dva nefunkční geny (SIX1 a SALL1), které jsou zodpovědné za diferenciaci ledvinových buněk a tvorbu tubulů. Bez lidských buněk byla prasečí embrya s defekty v těchto genech životaschopná, ale jejich ledviny se nevyvíjely tak dobře jako normálně. Když se vědci pokusili sestavit chiméru z upraveného prasečího embrya a upravených lidských buněk, získali pět životaschopných embryí, která se zakořenila v náhradních prasečích matkách. O měsíc později vědci tato těhotenství ukončili a embrya z dělohy odstranili. V oblasti, kde se měly nacházet jejich ledviny, si vědci pod mikroskopem všimli jasně červené záře – tedy lidské buňky zaujaly své zamýšlené místo. Ukázalo se, že ledvinový rudiment je o něco více než polovina člověka – podíl světelných buněk v něm byl 50–65 procent. Dvojité GMO To, co vyrostlo v čínském experimentu, samozřejmě ještě není plnohodnotná ledvina. Toto je pouze základ a částečně postavený z prasečích buněk. Navíc byl získán s extrémně nízkou účinností – pouze 5 embryí z 1820 zakořenilo. Projekt má před sebou ještě dlouhou cestu, aby dohnal upravená prasata a jejich orgány, které se již transplantují pacientům. Přesto se jedná o první rudiment lidské ledviny u prasete – a obecně první rudiment životně důležitého lidského orgánu získaného touto metodou. To znamená, že si již dokážeme představit, o kolik je tato technologie ekonomičtější ve srovnání s humanizací prasat – alespoň co se týče nutných genetických úprav. Prase, které se stalo prvním modifikovaným dárcem lidského srdce, neslo deset genetických změn. A ani ty nepomohly uklidnit imunitní systém nového majitele. Možná budou další generace dárcovských prasat potřebovat více těchto úprav. Kolik přesně, zatím není jasné. Například americký genetik George Church, známý svými ambiciózními nápady a velkými projekty, tvrdil, že je nutné z prasečího genomu vyčistit všechny endogenní retroviry – mobilní elementy, které se mohou pohybovat celým genomem a teoreticky mohou „skákat“ z dárcovského orgánu do lidských buněk. Jedná se o dalších 25 dodatečných úprav, celkem tedy téměř čtyřicet. A to asi není limit. V chiméře člověk-prase je zatím méně úprav: dvě v lidském genomu a další dvě v genomu prasete. Lai Liangxue a jeho spoluautoři ale tuší, že časem bude potřeba víc. Za prvé, se současným experimentálním designem stále nebude možné vypěstovat ledvinu, která neobsahuje jedinou prasečí buňku. I když vědci dosáhnou, že každý jednotlivý tubul ledviny je lidský, stále budou existovat krevní cévy a prvky pojivové tkáně. A pokud chceme, aby ledvina byla pro lidský imunitní systém zcela neviditelná, bude muset prase dárce vypnout i geny spojené s vývojem kapilár. Bude takové prase životaschopné? A co se stane s jejími dalšími orgány, kde se zřejmě usadí lidské buňky a vyklíčí lidské cévy? Za druhé, takto vedený experiment se může ukázat jako eticky riskantní. Co když se lidské buňky stanou součástí nejen ledvin, ale i nervového systému? Tam samozřejmě nebudou konkurenceschopní – a přesto to bude prasečí mozek s lidskými buňkami. Vědecká komunita dosud nestanovila žádný prahový podíl lidských buněk, po jehož dosažení je mozek považován za člověka. Jakýkoli experiment s chimérickým nervovým systémem tedy může vyvolat otázky etických komisí. Vědci proto svůj experiment zastavili 28. den vývoje. A zkontrolovali, že v prekurzorech mozku a míchy v embryích jsou pouze jednotlivé lidské buňky a v základech gonád – vůbec ne jediná. Lai Liangxue a spoluautoři se domnívají, že z etického hlediska lze jejich metodu učinit bezpečnější provedením ještě větších úprav genomu lidských buněk. Tedy vyříznout odtud některé geny, které jsou klíčové pro vývoj nervového systému a gonád. Pak se obě části chiméry ukážou jako méněcenné – ani jedna nepřežije sama o sobě a výsledný organismus bude mozaikou orgánů různých druhů. Vědci nespecifikují, které geny by mohly být dobrým cílem pro takové úpravy. A pro každý případ udělají výhradu: nové genetické zásahy mohou zabránit tomu, aby lidské buňky vytvořily plnohodnotnou ledvinu. Tak či onak, bude to vyžadovat mnohem více experimentů, abyste zjistili, zda je zde možný kompromis.
















