
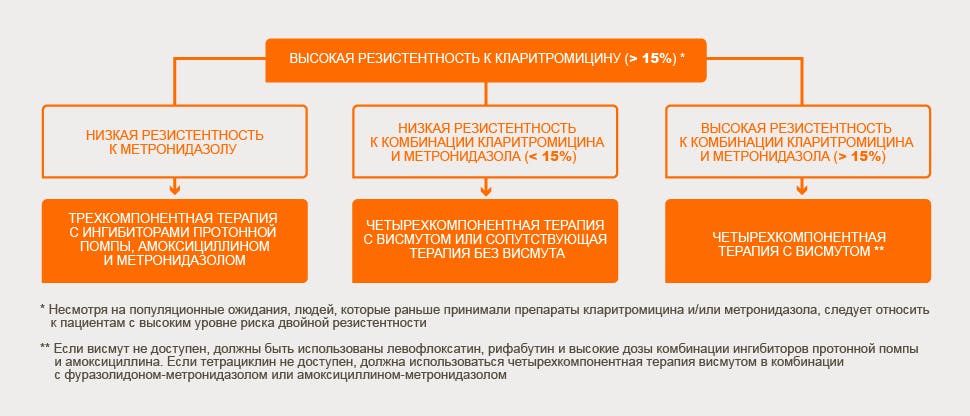
Neexistuje jediný obecně uznávaný léčebný režim pro infekci H. pylori. Všechny jsou však zaměřeny na zmírnění příznaků a hojení sliznice poškozené infekčním procesem 1. S přihlédnutím ke zvýšené antibiotické rezistenci k lékům používaným v eradikačních režimech H. pylori se doporučuje přistupovat k předepisování antibakteriálního léku individuálně s přihlédnutím ke klinickému obrazu a anamnéze i na základě testů citlivosti na antibiotika. U dospělých pacientů nedávná metaanalýza zjistila, že čtyřnásobná terapie (PPI a amoxicilin, metronidazol a klarithromycin po dobu 10–14 dnů) byla jednou z nejúčinnějších léčeb s vysokou mírou eradikace a přijatelným výskytem nežádoucích účinků 2 . V oblastech s vysokou (>15 %) duální rezistencí vůči klarithromycinu a metronidazolu je u dospělých preferovanou léčbou čtyřnásobná léčba obsahující vizmut. V ideálním případě je třeba se vyhnout klarithromycinu a používat kombinaci alternativních antibiotik, na které není rezistence (např. amoxicilin, tetracyklin, furazolidon, rifabutin) nebo rezistence, kterou lze úspěšně překonat zvyšováním dávek, dávkovacími intervaly a délkou léčby ( např. metronidazol) (obr. 1) 3.
Moderní schémata eradikační terapie a možnosti umocnění jejích výsledků
Antibiotická citlivost H. pylori
Citlivý na klarithromycin a metronidazol
Citlivý na metronidazol, rezistentní na klarithromycin
Citlivý na klarithromycin, rezistentní na metronidazol
Odolný vůči klarithromycinu a metronidazolu
PPI + klarithromycin + amoxicilin ve standardní dávce po dobu 14 dnů
PPI + metronidazol + amoxicilin 14 dní nebo čtyřnásobná terapie na bázi bismutu
PPI + klarithromycin + amoxicilin 14 dní nebo čtyřnásobná terapie na bázi bismutu
PPI + metronidazol + amoxicilin 14 dní s vysokou dávkou amoxicilinu nebo čtyřnásobnou terapií na bázi bismutu
Vysoká dávka PPI + metronidazol + amoxicilin po dobu 14 dnů nebo čtyřnásobná terapie na bázi bismutu
Vlastnosti léčby infekce H. pylori u dětí
Léčebné režimy používané u dětí jsou uvedeny na Obr. 2 4 .
Použití tohoto léčebného režimu vyžaduje objasnění v kontextu domácí pediatrické praxe. V současné době jsou relevantní pouze federální klinická doporučení pro diagnostiku a léčbu peptických vředů u dětí, která mají část věnovanou infekci H. pylori, ale je zaměřen spíše na Maastricht V než na doporučení ESPGHAN 5. Proto v současné době probíhají práce na vytvoření podobných klinických doporučení v Rusku 6 . U dětí, stejně jako u dospělých, je první linie eradikace založena na 14denní trojité léčbě pomocí PPI, amoxicilinu, klarithromycinu a metronidazolu. Výběr antibiotika je dán rezistencí kmenů H. pylori. S odporem H. pylori U metronidazolu i klarithromycinu odborníci z ESPGHAN (2016) doporučují zvýšit dávku amoxicilinu a/nebo zavést přípravky obsahující vizmut 4 . Důležité: některá doporučení zvažují možnost předepisování tetracyklinů a fluorochinolonů v případě rezistence nebo neúčinnosti terapie, což není v kontextu domácí pediatrické praxe povoleno 6 . Diskutováno by mělo být i předepisování vysokých dávek amoxicilinu podle doporučení ESPGHANA (2016), které se u nás dosud v praxi pediatrů nepoužívalo 6.
Využití probiotik v eradikační terapii
Maastrichtský konsensus V také klade velký důraz na používání probiotik jako součásti eradikačních režimů pro infekci H. pylori. Důvodem pro zařazení této skupiny léků je snížení vedlejších účinků antibakteriální terapie v rámci eradikačních režimů a také zvýšení účinnosti samotné eradikace 3. Mezi nejčastější gastrointestinální nežádoucí příhody spojené s antibiotickou terapií patří průjem, nauzea, zvracení, nadýmání a bolesti břicha, 7 které mohou vést k přerušení antibiotické terapie, což zvyšuje riziko terapeutického selhání a/nebo rozvoje H rezistence na antibiotika. Kromě toho je důležité užívání probiotik, aby se zabránilo rozvoji doprovodných infekcí. C. difficile 8 . Maastrichtský konsenzus také uvádí, že eradikace H. pylori by měla být prováděna opatrně u jedinců s nestabilní mikroflórou, aby se předešlo dlouhodobým následkům. V první řadě se samozřejmě bavíme o dětech 5,6. Dnes se však tato doporučení v ESPGHAN-2016 neodrážejí.
Zůstávají otázky týkající se účinnosti konkrétních probiotických kmenů, dávkování a délky adjuvantní probiotické terapie, jakož i geografických rozdílů a vlivů životního stylu (např. dieta, konzumace alkoholu, aktivní nebo pasivní kouření). Několik metaanalýz randomizovaných kontrolovaných studií hodnotilo účinnost probiotických doplňků při snižování vedlejších účinků spojených s eradikační terapií H. pylori včetně antibiotické terapie s celkově povzbudivými výsledky 9–12. Některé z těchto doplňků zahrnovaly probiotické kmeny bakterií Lactobacillus. Studie zkoumající probiotika s těmito bakteriemi prokázaly pozitivní výsledky 9-11. Jedna metaanalýza zdůraznila důležitost trvání probiotické léčby delší než 2 týdny 10 . Shromažďování údajů ze studií, které se liší v typech/kmenech, dávkách a délce probiotické terapie, však může vést k chybným závěrům, takže účinnost konkrétního kmene zbývá prověřit v samostatných studiích 13 .

Účinnost probiotik
V řadě studií, kdy byl do léčebného režimu přidán Lactobacillus rhamnosus GG, byly zaznamenány pozitivní efekty v podobě rychlosti eradikace H. pylori a také snížení výskytu průjmů souvisejících s léčbou 14. Jedna RCT u dětí použila kmen L. rhamnosus GG navíc ke standardnímu trojnásobnému eradikačnímu režimu. V této studii nebyl žádný rozdíl v rychlosti eradikace H. pylori nebo jejích vedlejších účinků 15 . Rozvoj AAD ve skupině LGG se zdál nižší, ale nebyl statisticky významný (6 vs 20 %, RR 0,3, 95% CI 0,07–1,2) 15 .
V metaanalýze R. Zhu et al. Bylo zahrnuto 14 RCT (2259 dospělých pacientů, 1124 standardní trojkombinace + probiotika, 1135 standardní trojkombinace); bylo prokázáno, že zavedení probiotik do eradikačních režimů významně zvýšilo účinnost terapie více než 1,5krát (OR=1,67; 95% CI 1,38–2,02) s dvojnásobným snížením rizika nežádoucích účinků (OR=0,49 95% CI 0,26–0,94). Současně bylo významně sníženo riziko průjmového syndromu (OR = 0,21; 95% CI 0,06–0,74) 16 . Jiná metaanalýza ukázala, že z celé řady kombinovaných probiotických látek byly účinné pouze dva léky, a to jak z hlediska prevence nežádoucích účinků léčby anti-Helicobacter, tak z hlediska zvýšení její účinnosti: 2-kmenový lék obsahující Lactobacillus acidophilus a Bifidobacterium animalis subsp. lactis BB-12, stejně jako 8-kmenná probiotická kombinace (L. acidophilus, L. casei rhamnosus, L. plantarum, L. reuteri, L. salivarius, L. sporogenes, B. infantis, B. longum) 17.

Helicobacter pylori je bakterie, která může žít v kyselém prostředí žaludku a na změněné sliznici dvanáctníku a způsobovat řadu onemocnění, jako jsou zánětlivá a ulcerózní léze horní části gastrointestinálního traktu. Kromě toho se v poslední době aktivně diskutuje o roli Helicobacter pylori ve výskytu rakovinných nádorů a lymfomů žaludku.
Samotnou bakterii ve tvaru spirály objevili němečtí lékaři již v roce 1874 v žaludku psů a v roce 1906 v žaludku lidí. Ale jeho význam ve vývoji některých běžných gastrointestinálních patologií se stal zřejmým až na konci dvacátého století. Zásadní roli zde sehráli dva australští výzkumníci: Barry Marshall a Robin Warren. Aby Barry Marshall dokázal, že Helicobacter pylori způsobuje zánět žaludku, provedl na sobě dokonce vizuální experiment. Vypil roztok s Helicobacter pylori a po pár dnech začal pociťovat zánět žaludeční sliznice. A pak použil antibakteriální léky k léčbě Helicobacter a dosáhl úspěchu. Tyto studie vědců Marshalla a Warrena byly v roce 2005 oceněny Nobelovou cenou za fyziologii a medicínu.
Co vyvolává výskyt patologie?
Moderní vědecký výzkum ukazuje, že Helicobacter pylori způsobuje nejméně polovinu ulcerózních lézí žaludku a dvanáctníku. Navíc infekce touto bakterií je mnohem širší než počet případů vředové choroby. To znamená, že u více než 90 % přenašečů bakterie nezpůsobuje žádné patologie. Na tomto základě se vědci domnívají, že pro nástup onemocnění přítomnost Helicobacter pylori nestačí, je zapotřebí i provokující faktor. Zvažují se tyto faktory:
- nadměrná tělesná hmotnost;
- kouření tabáku;
- užívání alkoholických nápojů;
- nadměrná vášeň pro sycené nápoje a kávu;
- porušení stravy a výživy;
- akutní a chronický psycho-emocionální stres;
- diabetes mellitus;
- sedavý způsob života.
Jaké jsou příznaky patologií způsobených Helicobacter pylori?
- Gastritida (zánětlivé onemocnění žaludeční sliznice).
Klinicky se projevuje bolestmi v epigastrické oblasti, nevolností, říháním, pocitem tíhy po jídle, pálením žáhy, celkovou slabostí a únavou. - Gastroduodenitida (zánět sliznice žaludku a dvanáctníku).
Jeho příznaky jsou bolesti břicha, které se objevují před jídlem i po jídle, nevolnost, poruchy stolice, slabost, poruchy spánku a bolesti hlavy. - Vřed (hluboký zánětlivý defekt sliznice a pod nimi ležících tkání žaludku nebo dvanáctníku).
Peptický vřed má recidivující průběh s exacerbacemi na podzim a/nebo na jaře. Hlavním příznakem patologie je bolest v horní části břicha. Pokud je vřed v žaludku, po jídle se objeví bolest, a pokud v duodenu, je pozorována „hladová bolest“ na prázdný žaludek, která zmizí při jídle. Také příznaky peptického vředu jsou pálení žáhy, kyselé říhání, hubnutí, nevolnost a zvracení po jídle.
Jaké jsou komplikace infekce Helicobacter pylori?
To jsou komplikace, které jsou charakteristické pro zánětlivé a ulcerózní léze sliznice. Za prvé to zahrnuje různé změny jizevnaté tkáně, které znesnadňují přesun potravy ze žaludku do dvanáctníku. Také může začít krvácení z poškozené sliznice, což se projevuje zvracením, které vypadá jako kávová sedlina, změnami krevních testů a celkovou slabostí. Vzácnější, ale také mnohem nebezpečnější komplikací je perforace vředu, tedy vznik průchozího otvoru ve stěně střeva či žaludku. Jedná se o akutní patologii, která vyžaduje okamžitý lékařský zásah.
Jak se určuje přítomnost Helicobacter pylori?
Mezi neinvazivními metodami identifikace tohoto mikroorganismu je ureázový dechový test považován za nejúčinnější. Jeho předností je jednoduchost a rychlost implementace (celá studie trvá cca 45 minut) a také vysoká spolehlivost. Tato analýza je založena na skutečnosti, že Helicobacter pylori je schopen syntetizovat enzym zvaný ureáza, který rozkládá močovinu na amoniak a oxid uhličitý. První část vydechovaného vzduchu se podává nalačno do utěsněného jednorázového sáčku. Poté vám dají k pití přesně definovaný objem roztoku močoviny. Po asi 30–40 minutách by měl pacient zhluboka vydechnout do dalšího uzavřeného vaku. Oba sáčky jsou odeslány do laboratoře, kde se měří koncentrace CO2 ve vzduchu, který obsahují. Pokud je ve druhém balení vyšší, znamená to přítomnost Helicobacter pylori.
Používají se i imunologické diagnostické metody: průkaz protilátek proti bakterii Helicobacter pylori v krvi. Ale nejzřejmější metodou pro detekci bakterií je mikroskopické vyšetření vzorků tkáně žaludku a dvanáctníku získaných během endoskopie a kultivace izolovaných mikroorganismů na umělých živných půdách.
















