Studium acidobazického stavu (ABC) nebo acidobazický stav (ABS) je důležitý při diagnostice a léčbě různých akutních stavů, včetně chirurgických.
Kyselost a zásaditost znamená koncentraci volných vodíkových iontů (H + ) v roztoku, tzn. pH krve. Pro efektivní fungování životně důležitých procesů musí být koncentrace volných vodíkových iontů (H + ) v přísných mezích. Studium acidobazické rovnováhy ve skutečnosti zahrnuje spolu s měřením pH i stanovení fyziologicky důležitých plynů přítomných v krvi (kyslík – O2 a oxid uhličitý – CO2) a asi 20 dalších parametrů. Všechny tyto ukazatele a jejich hodnoty spolu úzce souvisejí.
Pacienti na jednotce intenzivní péče a na operačním sále mohou zaznamenat významné změny v těchto ukazatelích během krátké doby. Studie akustické kyseliny se na rozdíl od všech ostatních typů laboratorních testů provádějí na vzorcích arteriální krve.
Pro normální fungování všech buněk v těle je zapotřebí kyslík (O2). Rozhodující roli v transportu kyslíku do tkání má hemoglobin obsažený v červených krvinkách. Termín “hemoglobin” se týká několika forem hemoglobinu, které jsou přítomny v lidské krvi, jak normálně, tak v patologii. Více než 98 % kyslíku absorbovaného plícemi z vdechovaného vzduchu se přenáší do buněk těla v krvi ve formě oxyhemoglobinu. Normálně krev obsahuje malá množství frakcí hemoglobinu, které nejsou schopny transportovat kyslík.2 – disemoglobiny (sulfhemoglobin, methemoglobin, karboxyhemoglobin).
methemoglobin se neustále tvoří v důsledku normálního metabolismu tělesných buněk. Methemoglobin obsahuje trojmocné železo a není schopen přenášet kyslík! Když se tvoří významné množství methemoglobinu, transportní funkce krve je ostře narušena. Organismus má mechanismus pro regulaci hladiny methemoglobinu v krvi, který udržuje podíl této frakce ne vyšší než 1,0 – 1,5 % celkového hemoglobinu.
Karboxyhemoglobin – silná sloučenina hemoglobinu (Hb) a oxidu uhelnatého (CO). Karboxyhemoglobin se tvoří velmi rychle, protože schopnost oxidu uhelnatého vázat se na hemoglobin je přibližně 200krát vyšší než schopnost kyslíku. Karboxyhemoglobin není schopen přenášet kyslík do tkání těla, proto v případě otravy oxidem uhelnatým může u člověka rychle nastat smrt. Karboxyhemoglobin vzniká ve velkém množství při otravě oxidem uhelnatým a v malém množství je vždy přítomen v krvi všech kuřáků a obyvatel velkých měst.
indikace:
Je nutná analýza ABL
· Pro stanovení diagnózy Analýza krevních plynů je nedílnou součástí diagnostiky respiračního selhání a primární hyperventilace. Detekuje také metabolickou acidózu a alkalózu.
· K posouzení závažnosti onemocnění
· Ke sledování účinnosti léčby taková analýza je velmi důležitá pro výběr oxygenoterapie (O2) pro pacienty s chronickým respiračním selháním typu 2 a pro optimalizaci nastavení ventilátoru.
Ke zvýšení methemoglobinu (FMetHb) v krvi dochází, když:
· otravy dusitany, dusičnany, nitrososloučeninami, anilinem, sulfonamidy, acetanilidem, chloridy, bromidy atd.
· dědičný deficit NADH-methemoglobin reduktázy: nízká enzymatická aktivita se projevuje již v raném dětství. Toto onemocnění nemá zpravidla žádné klinické následky, projevuje se jako drobná kosmetická vada.
přítomnost abnormálních variant hemoglobinu, označovaných jako hemoglobin M
Ke zvýšení karboxyhemoglobinu (FCOHb) v krvi dochází, když:
· otrava oxidem uhelnatým. Když je hladina FСOHb nad 30%, jsou pozorovány silné bolesti hlavy, celková slabost, zvracení, dušnost, tachykardie a na úrovni 50% – křeče, kóma; nad 70 %, dochází k respiračnímu selhání a je možná smrt.
Metodologie:
Stanovení krevních plynů, acidobazického stavu, oxymetrických parametrů se provádí na analyzátoru ABL 800 FLEX od firmy RADIOMETR, Dánsko, stanovení až 50 parametrů.
Příprava:
Není nutná žádná speciální příprava!
Článek uvádí údaje o strukturní organizaci endotelu u experimentální laktátové acidózy. Bylo provedeno několik sérií experimentů, ve kterých byla acidóza vytvořena zavedením 3% roztoku kyseliny mléčné s různou hloubkou od pH 7,25 do pH 6,8 a trváním od 15 do 180 minut. S rozvojem acidózy se v krevním řečišti objevují agregáty krevních destiček a červených krvinek, které jsou při nekompenzované laktátové acidóze nahrazeny krevními sraženinami a poruchou mikrocirkulace. Elektronová mikroskopie odhaluje známky mitochondriální dysfunkce v endoteliálních buňkách. Dochází k rozpadu cytoplazmy, vzniku mikrovezikul a mikročástic, k narušení struktury jádra, mitochondrií, k prasknutí cytoplazmatických membrán jednotlivých buněk. Posun pH o 7,0 vede k destrukci endoteliálních buněk a vstupu buněčných organel, které mají převážně prokoagulační aktivitu, do krevního řečiště.

metabolická acidóza
morfologie
mikrovezikuly
1. Kuznik B.I. Buněčné a molekulární mechanismy regulace systému hemostázy za normálních a patologických stavů: monografie. – Chita: Express Publishing House, 2010. – 832 s.
2. Zubairov D.M., Zubairova L.D. Mikrovezikuly v krvi, funkce a jejich úloha při tvorbě trombu. – M.: Geotar-Media, 2009. – 168 s.
3. Inzhutova A.I., Salmina A.B., Petrova M.M. Role CD38 v mezibuněčných interakcích při endoteliální dysfunkci // Bulletin. zk. biol. – 2008. – č. 145 (6). – s. 648–652.
4. Ginsberg M.D. Nové strategie prevence poškození nervů v důsledku ischemické mrtvice. – 1994. – 34 s.
5. De Backer D. Laktátová acidóza // Intensive Care Med. – 2003. – Sv. 29. – S. 699–702.
6. Kette F., Weil M.H., Von Planta M. Pufrovací činidla nezvrátí intramyokardiální acidózu během srdeční resuscitace // Cirkulace. – 1990. – Sv. 81. – S. 1660–1666.
7. Pirro M., Schillaci G., Bagaglia F. a kol. Mikročástice odvozené z endoteliálních progenitorových buněk u pacientů s různým kardiovaskulárním rizikem // Ateroskleróza. – 2008. – 197 (2). – R. 57–67.
8. Connett R.J., Gaueski T.E., Honig C.H. Akumulace laktátu v plně aerobním, pracujícím psím svalu gracilis // Am. J. Physiol. – 1984. – 246. – S. 120–128.
Poškození struktury buněk, mezibuněčné hmoty, tkání a orgánů, doprovázené narušením jejich životních funkcí, je zpravidla důsledkem poruchy metabolické regulace [1]. Narušení redoxních procesů a intracelulárního dýchání, vedoucí k hromadění protonů ve tkáních a rozvoji acidózy, vede k destruktivním a dystrofickým poruchám v různých orgánech a tkáních. Metodou přímého měření intramyokardiálního pH při kardiopulmonální resuscitaci bylo prokázáno, že i krátké období srdeční zástavy způsobené fibrilací je charakterizováno hlubokou acidózou myokardu – po 5 minutách srdeční zástavy, kdy je pH arteriální krve stále normální a pH smíšené žilní krve je 7,26, intramyokardiální pH klesá na 6,95 [6].
Acidóza hraje významnou roli v mechanismech regulace fyziologických funkcí při fyzické aktivitě. V procesu intenzivní fyzické práce dochází ke zvýšení obsahu kyselých metabolických produktů, které způsobují posuny v krevním CBS. V některých případech může pH arteriální krve u vysoce kvalifikovaných sportovců klesnout na 7,0 a dokonce o něco nižší. Hromadění kyselých metabolických produktů je způsobeno především nesouladem mezi potřebou kyslíku a jeho spotřebou, což vede ke zvýšení laktátu v krvi a snížení pH [5, 8].
Snížení pH intra- a extracelulárního prostředí má také přímý cytotoxický účinek, způsobuje „uvolňování“ buněčných membrán, mění jejich fyzikálně-chemické vlastnosti, podporuje zvýšenou permeabilitu neuronů a vaskulárního endotelu. Otok endoteliálních buněk prohlubuje poruchy mikrocirkulace a v důsledku toho postischemickou hypoperfuzi neboli fenomén „neobnoveného průtoku krve“ [4].
Na kompenzaci posunů pH se vždy podílí extracelulární prostor. Zde pocházejí z buňky nedostatečně oxidované metabolické produkty. Během procesu výměny vody jsou kyselé produkty přenášeny celým tělem a redistribuovány do zón s nízkou produkcí protonů. V tomto ohledu má základní látka pojivové tkáně a kolagenová síť významnou kapacitu adsorpce kationtů. Za různých patologických stavů podléhá pH intracelulárního prostředí výrazným výkyvům a může klesnout až na 6,6–6,4 [5].
Za těchto podmínek je studium morfologie tkání během acidózy různé hloubky a trvání zvláště důležité pro pochopení dynamiky patologického procesu u různých onemocnění.
Účelem studie bylo studovat rysy strukturní organizace endotelu u laktátové acidózy.
Materiály a metody výzkumu
Studie byly provedeny na outbredních zvířatech (42 koček). Laktátová acidóza vznikla zavedením 3% roztoku kyseliny mléčné v izotonickém roztoku NaCl do femorální žíly v hexenální anestezii. Různých posunů pH na kyselou stranu bylo dosaženo dávkovanou kapkovou injekcí laktátu, obvykle od 20 do 38 kapek za minutu. pod kontrolou pH (pH metr MP 120BE). Bylo provedeno několik sérií experimentů, ve kterých byla vytvořena acidóza různé hloubky (od pH 7,2 do pH 6,9) a trvání (od 15 do 180 minut). K provedení histologických a histochemických studií byly kousky srdeční tkáně o velikosti 0,5–1,0 cm fixovány v 10% pufrovaném neutrálním roztoku formaldehydu (pH 7,0) při teplotě 18–20 °C po dobu 24–48 hodin. pomocí parafínu (G.A. Merkulov, 1969). Byly použity metody barvení morfologického materiálu: hematoxylin-eosin, hematoxylin-pikrofuchsin podle Van Giesona. Elektronová mikroskopie byla provedena při pH krve 7,4 (kontrola), 7,2 a 7,0 (experiment) 15 a 30 minut po začátku acidózy. Ultrastrukturální analýza tkání byla provedena pomocí mikroskopu IEM-7A (Japonsko) při urychlovacím napětí 50 kV a zvětšení na obrazovce mikroskopu 6000–30000krát. Zvířata byla usmrcena předávkováním hexenální anestezií. Při práci s pokusnými zvířaty byly splněny požadavky stanovené v „Metodických doporučeních pro provádění lékařského a biologického výzkumu na zvířatech“ z roku 1985.
Výsledky výzkumu a diskuse
Posun pH krve na 7,25 a níže po dobu 15–60 minut je doprovázen městnáním orgánových cév, edémem cévní stěny a perivaskulárního prostoru, lymfostázou a agregací krvinek. Pomocí optické mikroskopie jsou pozorovány jevy stagnace krve různého stupně závažnosti, agregáty krevních buněk a tvorba krevních sraženin a mikrotrombů v různých částech vaskulární sítě. Morfologické změny s posunem pH k 7,2 vedou nejen ke změnám agregátního stavu krve a narušení mikrocirkulace, ale způsobují i narušení struktury cévní stěny a cévního endotelu (obr. 1, 2).
Podle elektronové mikroskopie se již během prvních 15–30 minut acidózy při pH krve 7,2 mění konfigurace buněčného povrchu kapilárních endoteliálních buněk. Tyto změny jsou pozorovány v různých orgánech – v myokardu, žaludku, játrech. Zvyšuje se počet mikropinocytotických váčků, které se odlamují a vstupují do lumen kapilár (obr. 3, 4). Především se mění struktura mitochondrií. U některých endoteliocytů mají mitochondrie vejčitý tvar s hustou matricí a mírně rozšířenými kristami, mitochondriální matrice je ostře vyčištěna a kristy jsou zkrácené nebo zcela redukované. Cytoplazma endoteliálních buněk je světlá a prakticky neobsahuje mikrovezikuly. Mitochondriální matrice je ostře vyčištěna a kristy jsou zkráceny nebo zcela redukovány. V granulárním cytoplazmatickém retikulu a lamelárním komplexu dochází k výrazné expanzi cisteren, fragmentaci do velkých vakuol. Počet ribozomů je prudce snížen. U mnoha endoteliálních buněk prochází buněčný povrch významnými ultrastrukturálními změnami. V jádrech endotelových buněk se mění struktura karyoplazmy: její granulární složky se hromadí hlavně v blízkosti vnitřní vrstvy jaderné membrány a perinukleární prostor se rozšiřuje. Některé endoteliální buňky jsou ve stavu edému: jejich vnější obrysy jsou značně vyhlazené a plazmatická membrána v některých oblastech vykazuje známky destrukce. Další posun pH na 7,0 po dobu 30 minut vede k destrukci cytoplazmatické membrány a uvolnění organel do lumen kapilár, které mají zjevně prokoagulační aktivitu; je také pozorována separace od bazální membrány a později – deskvamace endoteliálních buněk (obr. 5).

Rýže. 1. Podélný řez myokardem levé komory. Cévy mikrovaskulatury jsou většinou pareticky dilatované, cytoplazma vaskulárních endoteliálních buněk je zhutněná, v lumen cév a v diapedetických extravazátech se nacházejí sféroidní erytrocyty a kal erytrocytů. pH krve 7,2 – 60 minut. Hematoxylin-eosin. UV: sv. 20. Mikrofotografie
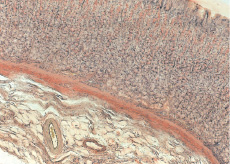
Rýže. 2. Žaludek při pH 7,0 a acidóze po dobu 120 minut. Silný otok submukózní vrstvy, vaskulární trombóza, eliminace glykogenu v buňkách sliznice. Karmín podle Besta, uv. O. 10 cca. 10
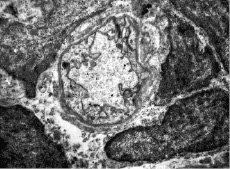
Rýže. 3. Kočičí myokard. Kapilára obklopená pericyty při metabolické acidóze (pH krve 7,2, expozice 15 min). Endoteliální buňky kapiláry tvoří výběžky, které se odlamují a vstupují do lumen kapiláry. Perikapilární edém. UV 7 000. Elektronová mikrofotografie
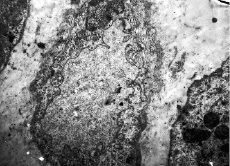
Rýže. 4. Žaludek kočky s metabolickou acidózou (pH krve 7,2, expozice 30 min). Endoteliocyt při pH krve 7,2 a acidóze po dobu 30 minut. Porušení struktury cytoplazmatické membrány, tvorba. Perikapilární edém. UV: 15 000. Elektronová mikrofotografie
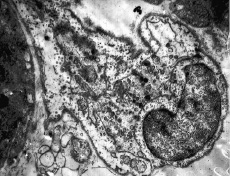
Rýže. 5. Myokard, levá komora s metabolickou acidózou (pH krve 7,0, expozice 30 min). Cytoplazmatická membrána endoteliální buňky je zničena, buněčné organely vstupují do lumen kapiláry a do mezibuněčného prostoru. UV: 25 000. Elektronová mikrofotografie
Endotel je dynamický orgán zapojený do široké škály procesů hemostázy, které zahrnují udržování tekutého stavu krve, řízení vaskulárního tonu a transport živin mezi krví a podkladovými tkáněmi. Cévní endotel udržuje stav tekutého agregátu krve inhibicí koagulace krve a potlačením agregace krevních destiček [2, 3]. Endoteliální buňky vylučují mediátory, které regulují hemodynamiku a enzymy zapojené do procesů srážení krve. Jedná se o oxid dusnatý, který vede k vazodilataci a zároveň inhibuje adhezi leukocytů, adhezi a agregaci krevních destiček a způsobuje jejich disagregaci, potlačuje migraci a proliferaci buněk hladkého svalstva. Aktivované endoteliální buňky navíc mohou do extracelulárního prostoru uvolňovat fragmenty své plazmatické membrány (mikro- a nanovezikuly), které si zachovávají prokoagulační fenotyp původních buněk, a vytvářejí tak mechanismus pro proces diseminované koagulace. Při acidóze jsme také pozorovali deformaci buněčné membrány endoteliálních buněk a tvorbu mikrovezikul. Endoteliální mikrovezikuly u některých onemocnění odrážejí stav endoteliální dysfunkce [2]. Membránou uvolňované mikročástice hrají důležitou roli při zánětech, koagulaci a změnách fungování cévního endotelu, které mohou vést k ateroskleróze, arteriální hypertenzi a dokonce i diabetes mellitus [7].
Při akutní laktátové acidóze se tedy podle elektronové mikroskopie objevuje deformace cytoplazmatické membrány endotelu a vznikají mikrovezikuly, které mají prokoagulační aktivitu. Podle světelné mikroskopie se při posunech pH k 7,2 a délce acidózy od 30–60 minut detekuje především kal erytrocytů v cévách. Další posun pH a zvýšení expozice acidóze na více než 60 minut vede ke vzniku krevních sraženin a hluboké poruše mikrocirkulace.
Práce byly provedeny v rámci Státního zadání pro univerzitu Ministerstva školství a vědy Ruské federace, č. 2707.
Recenzenti:
Avseenko N.D., doktor lékařských věd, profesor katedry bezpečnosti života a ochrany životního prostředí, Transbaikal Institute of Railway Transport, Chita;
Bochkarnikova N.V., kandidátka lékařských věd, docentka katedry lékařských a biologických základů tělesné kultury, Transbaikal State University, Chita.
Práce obdržela redaktorka 16.12.2014. dubna XNUMX.















